先 조치 치료 약 렘데시비르, 코로나 19 진단 시약 3개 '긴급사용 승인'
덱사메타손, 급성호흡기증후군과 같은 '중증' 환자에 한정, 투여 적절
히드록시클로로퀸, 치료 유익성 인정되지 않아 5건 모두 '조기 임상 종료'
[보건타임즈] 첫 코로나 치료에 항바이러스제 렘데시비르가 처방된 것을 시작으로 응급 선별할 목적으로 코로나 19 진단 시약 ▲ ㈜에스엠엘제니트리의 Ezplex® SARS-CoV-2 FAST Kit ▲ ㈜바이오세움의 Real-Q Direct SARS-CoV-2 Detection Kit ▲ ㈜랩지노믹스의 LabGunTM COVID-19 Fast RT-PCR Kit 3개를 긴급 사용토록 허용, 본격적으로 계속 쏟아져 나올 것으로 보인다.
의료현장에서 처방되는 '렘데시비르(remdesivir)'는 산소치료가 필요한 코로나 19 중증환자에게 5일 투여를 원칙으로 하되 환자의 상태에 따라 10일로 연장, 투약하도록 긴급사용하도록 미국식품의약국(FDA)으로부터 처음 승인된 약이다.
이 약은 미국 국립보건연구원(NIH)이 주도로 2020년 초부터 10개국, 73개 의료기관이 참여한 가운데 코로나 19 환자 1063명을 대상으로 안전성과 치료 효과를 검증에 들어가 투약 받은 환자가 대조군 위약 군보다 회복시간이 15일에서 11일로 31% 단축됨이 확인됐다.
이어 한국 식약처는 응급 선별검사로 사용할 목적으로 코로나 19 진단 시약 3개를 긴급 사용토록 승인했다.
이처럼 5월을 기점으로 코로나 19 치료제로 렘데시비르와 6월부터는 진단 시약이 의료현장에 공급되기 시작했으나 이들 품목은 안-유를 입증해야 하는 허가과정을 면제받은 '긴급사용 승인'이란 공통점이 있다.
우리나라의 진단 시약 '긴급사용 승인'은 현행법에 의거 감염병 대유행이 우려돼 긴급하게 필요하지만, 국내에 허가제품이 없다든지 또는 제조‧허가 등을 받아 사용되는 치료약의 공급이 부족, 허가나 부족할 것으로 예측될 때 중앙행정기관이 요청한 진단 시약을 식약처장이 승인, 한시적으로 제조․판매․사용할 수 있게 하는 제도다.
이 제도는 미국 '긴급사용 승인'제도의 목적이나 취지와 다르지 않다.
이 때문에 코로나 19 치료 현장에선 유효성과 효과가 확실한 치료제가 나와 주길 바라고 있다.
이런 바람과 함께 6월 8일을 기준으로 안전성과 유효성을 검증하는 임상에 들어간 미국국립보건원(NIH)의 ClinicalTrials.gov에 신규 등록된 코로나 19 약물 중재 임상시험(Drug Interventional Clinical Trials)이 무려 858건에 이르고 있다.
이들 약은 안전성과 유효성을 검증하는 전 임상, 1상, 2상, 3상 단계의 코로나 19 치료약물 중재 임상 중에 있다.
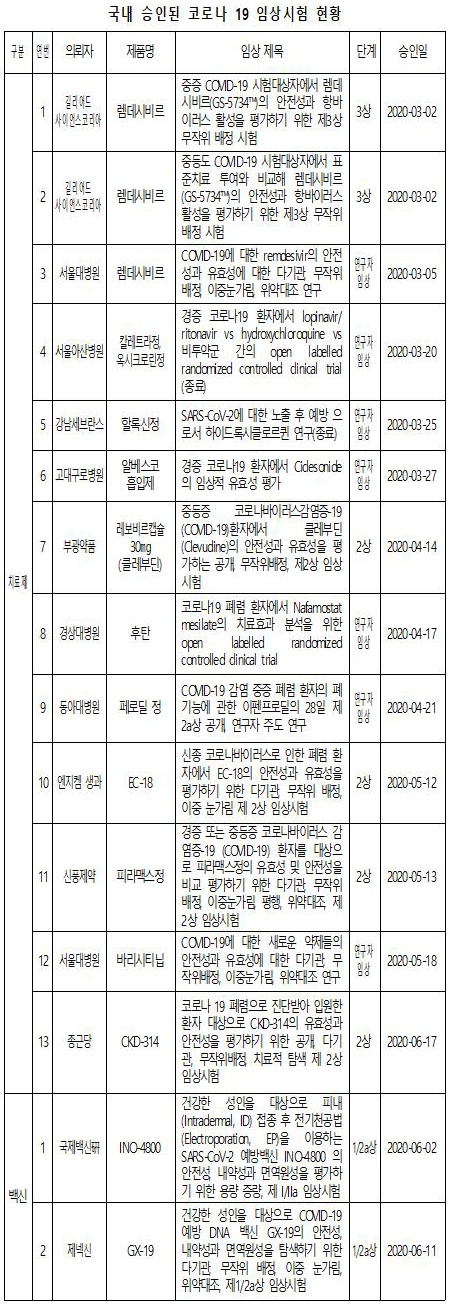
이렇듯 한국도 치료제 13건, 백신 2건 총 15건이 임상시험계획(IND)을 승인받아 임상을 착수했거나 이미 들어간 상태다.
식약처가 공개한 국내외 코로나 19 치료제와 백신 등의 개발상황은 이렇다.

치료제·백신 임상승인 현황= 현재, 국내에서 코로나 19치료제 13건과 백신 2건을 합쳐 총 15건의 IND가 승인됐다.
이중 코로나 19치료제 13건의 개발 단계별로 들여다보면 3상 2건, 2상 4건, 연구자 임상시험 7건이다.
이 가운데 우리나라에서 개발한 치료제로는 클레부딘(2상, 부광약품, B형 간염치료제로 기허가), 피라맥스(2상, 신풍제약, 말라리아치료제로 기허가), EC-18(2상, 엔지켐생명과학), 나파모스타트(2상, 종근당, 항응고제로 기허가)가 있다.
백신 2건은 모두 초기 단계(1상~2상)에 있다.
우리나라가 개발한 백신으로는 GX-19(1/2상, 제넥신)가 있다.
치료제·백신 개발 현황=미국 'L사'가 항체치료제의 코로나 19 치료효과를 임상하고 있다.
류마티스 관절염 치료제로 사용되는 'R사'의 제품도 미국, 중국 등에서 임상 중이다.
국내에선 'C'사가 항체치료제를 개발하고 있으며 임상시험 준비단계에 들어간 상태다.
혈장치료제로는 국내 'G사'가 완치된 환자의 혈장을 이용, 치료제를 개발하고 있으며, 현재 임상 2상을 준비 중이다.
아직 상용화된 코로나 19 감염을 예방할 수 있는 백신은 전 세계적으로 없다.
해외에서는 영국 옥스퍼드 대학이 개발한 백신이 임상2/3상 단계, 중국 C사와 미국 M사가 각각 개발 중인 백신은 임상 2상 단계, 나머지 12개 백신은 임상 1/2상 또는 1상 단계에 있다.
우리나라는 DNA 백신이 개발 중이며 현재 임상 1/2상 단계에 들어갔다.
치료제 사용 현황= 최근 국내외에서 공개된 덱사메타손, 히드록시클로르퀸 등의 치료정보를 정리하면 이렇다.
최근 영국의학계가 발표한 임상결과에 따르면 염증억제작용이 있는 합성 부신피질호르몬제(스테로이드) '덱사메타손'은 중증환자의 사망률을 낮추는 데 효과가 있다는 것으로 전해졌다.
이에 식약처는 면역억제 작용을 통해 치료 효과를 나타내는 것으로 급성호흡기증후군과 같은 '중증' 환자에 한정, 의사가 환자의 상태를 관찰하면서 투여하는 것이 적절할 것으로 보인다고 평가했다.
식약처는 덱사메타손의 국내 수급이 원활한 상태로, 정제와 주사제 14개 품목이 생산되고 있으며, 정제는 연간 약 4천 3백만 정, 주사제는 연간 약 6천만 앰플이 생산되고 있다고 밝혔다.
히드록시클로로퀸은 올해 6월 국제보건기구(WHO)와 미국 국립보건원(NIH)이 임상시험 자료를 분석한 결과, 환자에게 치료적 유익성이 인정되지 않는 것으로 판단, 임상을 중단할 것임을 발표했다.
국내에선 총 5건의 히드록시클로로퀸 임상시험이 승인됐으나, 국내외 임상시험에서 치료적 유익성이 인정되지 않는 등 5건 모두 조기에 임상이 종료됐다.